Legemidler og biotek
Norge sa nei - Sverige innfører ny presisjonsmedisin til pasienter med aggressiv brystkreft
Det svenske Rådet for nya terapier, NT-rådet, har vedtatt at presisjonsmedisinen Enhertu skal tilbys som tredjelinjebehandling til pasienter med inoperabel metastatisk HER2 positiv brystkreft. I november sa Beslutningsforum nei til å innføre legemidlet i Norge.
Enhertu er et målrettet legemiddel som kan hjelpe de om lag 470 kvinnene som hvert år får den aggressive og uhelbredelige HER2-positiv diagnosen. I følge legemiddelverket er om lag 50-60 pasienter aktuelle for behandling med Enhertu hvert år i Norge.
Både Brystkreftforeningen, Kreftforeningen og Norsk Brystcancer Gruppe har reagert på at Beslutningsforum på sitt møte den 22. november vedtok at pasienter i den offentlige helsetjenesten ikke får tilgang til Enhertu. Foreningene mener at pasientene må få legemidlet siden det bedre enn behandlingen som tilbys i dag.
Slik begrunner Beslutningsforum sitt nei
Beslutningsforums begrunnelse for avslaget var dette:
- Enhertu har god effekt på metastatisk HER2-positiv brystkreft som er tidligere er behandlet med Kadcyla.
- Men datagrunnlaget er for spinkelt til å konkludere hvor mye mer effektiv Enhertu er i forhold til dagens behandlingstilbud i tredjelinje som er Herceptin pluss kjemoterapi.
- Behandlingen er dessuten mye dyrere enn behandlingen pasientene i dag får i tredjelinje.
- Kostnaden for legemidlet er for høy i forhold til den usikre merverdien for pasientene.
- Med tilgjengelig dokumentasjon er det ikke mulig å vurdere relativ effekt i forhold til dagens behandlingsalternativer. Dessuten er prisen er høy, sa Inger Cathrine Bryne som er leder i Beslutningsforum til HealthTalk den 22. november da beslutningen ble tatt.
Slik begrunner NT-rådet sitt ja
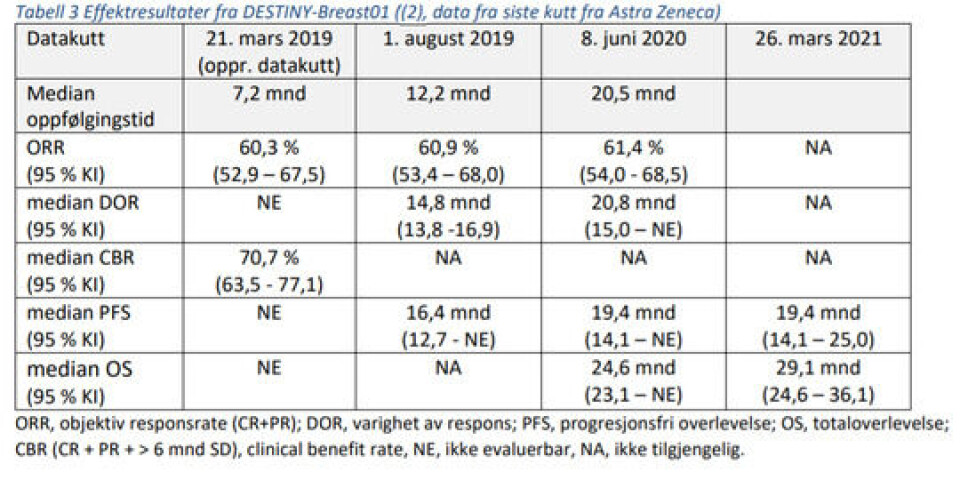
NT-rådet som er Sveriges motsats til Beslutningsforum har hatt tilgang til den samme kliniske dokumentasjonen som Beslutningsforum - fase 2-studien DESTINY-Breast01, som inkluderte 184 pasienter. Studien er publisert i The New England Journal of Medicine. Progresjonsfri i overlevelse (PFS) og totaloverlevelse (OS) var sekundære endepunkter i studien og var henholdsvis 19,4 og 29,1 måneder ved nyeste datakutt (26. mars 2021). Primærendepunktet i studien er objektiv responsrate (ORR) og datakutt fra sommeren 2020 viser at Enhertu reduserte tumoren hos 61,4 prosent av pasientene.
I motsetning til Beslutningsforum konkluderer NT-rådet med at de svenske kreftsykehusene nå kan ta i bruk Enhertu.
NT-rådet begrunner på grunnlag av en metodevurdering av Tandvårds- och läkemedelsförmånsverket (TLF) - som tilsvarer det norske Legemiddelverket - sitt vedtak slik:
- Sykdommens alvorlighet er høy
- Effekten av behandlingen er moderat, men er klinisk relevant
- Diagnosen er ikke vanlig
- Usikkerheten i den vitenskapelige dokumentasjonen er meget høy
- Usikkerhet i den helseøkonomiske analysen er høy.
Enhertu er kostnadseffektiv
TLF beregner i sin analyse av kostnadseffektivitet at kostnaden per kvalitetsjustert leveår (før rabatt) for Enhertu sammenlignet med dagens standardbehandling Herceptin (trastuzumab) i kombinasjon med kjemoterapi er omtrent 1 050 000 SEK.
NT-rådet konkluderer med at:
“En samlet vurdering av ovenstående faktorer gjør at Enhertu kan betraktas som kostnadseffektiv.”
Anbefalingen til NT-rådet er som nevnt basert på studien DESTINY-Breast01. Denne studien legger også Legemiddelverket til grunn i sin metodevurdering. Men i motsetning til TLF mente Legemiddelverket at dataene fra DESTINY-Breast01 studien var gode nok til å lage en kostnads- nytteanalyse.
Beslutningsforums leder Inger Cathrine Bryne forteller HealthTalk at med avslaget er saken nå ferdig behandlet, men vi vil gjøre en ny vurdering når det foreligger nye data i form av en randomisert fase 3-studie og denne forventes våren 2022.