Legemidler og biotek

Amgen har fått FDA-godkjenning for den første KRAS-blokkerende lungekreftmedisinen
På fredag godkjente Food and Drug Administration det første legemidlet som hjelper pasienter med lungekreft som skyldes en genetisk mutasjon i et protein som heter KRAS. Leger og forskere har jobbet i 40 år med å finne en effektiv behandling for denne kreftformen. Nå er endelig arbeidet kronet med seier.
Den nye legemidlet er en pille som heter Lumakras (sotorasib) som er utviklet av Amgen.
Lumakras ble godkjent for å behandle pasienter med avansert ikke-småcellet lungekreft som inneholder en spesifikk type KRAS-mutasjon kalt G12C.
Mutasjonen, som tidligere ikke kunne behandles, finnes i omtrent 13 prosent av de ikke-småcellede lungekreftsvulstene. Dessuten har 1-3 prosent av pasienter med tarmkreft og andre kreftformer også en KRAS G12C-mutasjon.
Slutter seg til en voksende liste over målrettede kreftlegemidler
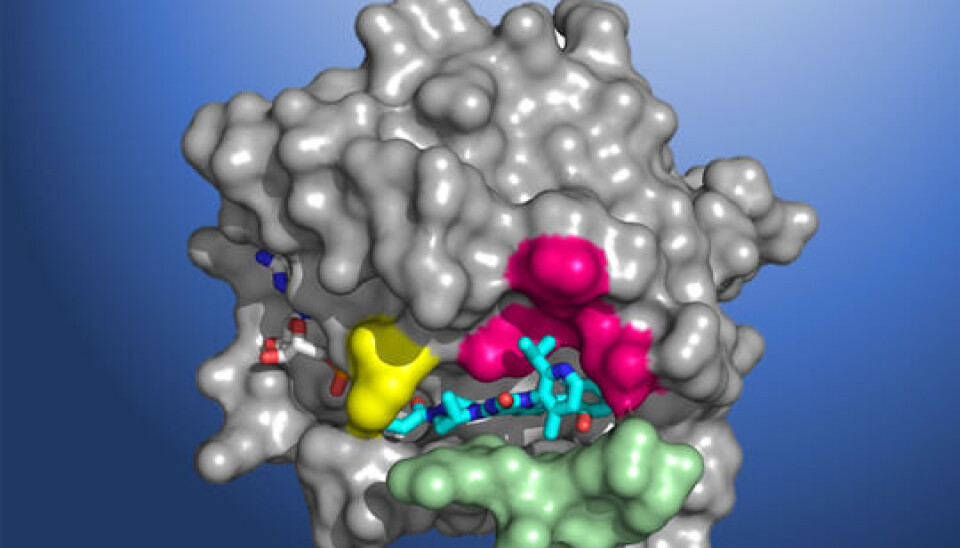
- KRAS G12C er en drivermutasjon i kreftcellen og sender et vekstsignal til cellekjernen at den skal dele seg og vokse. Lumakras hemmer dette enzymet slik at det ikke sender disse signalene innover i kreftcellen, har onkolog og leder i Norsk lungekreftgruppe Odd Terje Brustugun Brustugun tidligere fortalt HealthTalk.
Behandlingen vil koste 17 900 dollar per måned før rabatter, eller 214 800 dollar per år, opplyser Amgen. Selskapet startet de første kliniske forsøkene på mennesker for bare tre år siden.
Lumakras slutter seg til en voksende liste over målrettede kreftlegemidler som gjør det mulig for leger å behandle solide svulster mer effektivt når veksten er drevet av svært spesifikke genetiske mutasjoner. Dette gjelder spesielt i lungekreft, hvor det er flere legemidler som retter seg mot genmutasjoner som ALK, ROS1, EGFR og RET - og nå også KRAS G12C. Disse mutasjonene er imidlertid sjeldne, noe som gjør det utfordrende å identifisere pasienter og få dem behandlet.
Leger og forskere har jobbet i 40 år med å finne en effektiv behandling for denne kreftformen, sa Odd Terje Brustugun til HealthTalk da Amgen for en tid tilbake gikk ut med topplinjedata fra CodeBreaK 100 fase II studien.
Denne studien ligger til grunn for FDA-godkjenningen og inkluderte 126 pasienter med avansert ikke-småcellet lungekreft, som alle ble testet for å bekrefte at de hadde KRAS G12C-mutasjonen. Resultatene fra studien viser at Lumakras reduserte svulstene hos 37% av pasientene med avansert ikke-småcellet lungekreft og stoppet svulstprogresjonen med litt under syv måneder.
37% oppnådde klinisk meningsfull svulstreduksjon
Pasientene i studien hadde tidligere blitt behandlet med median to kreftlegemidler, inkludert immunterapi, som alle hadde sluttet å virke. CodeBreaK 100 var en enarmet studie, som betyr at alle pasientene ble behandlet med Lumakras , ingen fikk placebo eller andre medisiner som fungerte som en komparator.
Studien viste at 46 av 124 evaluerbare pasienter, eller 37%, oppnådde klinisk meningsfull svulstreduksjon med Lumakras-behandlingen. Hos tre pasienter ble svulstene eliminert fullstendig, noe som betyr at de hadde en komplett respons. For de 46 komplette og delvise respondentene var median varighet av svulstrespons 10 måneder. For alle 126 lungekreftpasienter i studien var median progresjonsfri overlevelse (PFS) - som betyr hvor lenge pasienter lever før svulstene begynner å forverres - 6,8 måneder.
Amgen gjennomfører nå en fase 3-studie der Lumakras blir sammenlignet med cellegift. Selskapet kjører også studier som administrerer andre legemidler som som immunterapi (sjekkpunkthemmere) i tillegg til Lumakras for å se om kombinasjonsterapi kan vise bedre effekt.
På ASCO som starter 4, juni skal Amgen presentere tall for totaloverlevelse (OS) og subgruppeanalyser fra fase 2 studien CodeBreaK 100.
Vil snart bli godkjent i EU og Norge
Amgen har også søkt den Europeiske legemiddelbyrået EMA om markedsføringstillatelse, og med FDA-godkjenningen er det så godt som utenkelig at Lumakras ikke også blir godkjent i EU og dermed også i Norge.
Odd Terje Brustugun forteller til HealthTalk at i dag er immunterapi og kjemoterapi i kombinasjon førstelinjebehandlingen for denne pasientgruppen. - Pasienter som ikke har effekt på denne behandlingen går over til cellegift alene, og her kan vi se responsrater helt nede i 10 prosent og ganske kortvarig effekt samt en del bivirkninger. Bivirkningene med Lumakras er generelt milde, selv på den høyeste dosen 960 mg daglig. 20 prosent av pasientene har bivirkninger på grad 3 og 4. Dette er bivirkninger som merkes, men den behandlingen vi kan tilby i dag gir langt flere og alvorligere bivirkninger enn Lumakras, sier Brustugun.